Pernahkah Anda bertanya mengapa es mencair di tangan Anda atau bagaimana kulkas bisa membuat minuman Anda tetap dingin di hari yang panas? Jawabannya ada pada termodinamika, cabang ilmu fisika yang mempelajari hubungan antara panas, energi, dan kerja. Termodinamika bukan sekadar teori abstrak yang hanya relevan di laboratorium—ia ada di mana-mana, dari mesin mobil yang Anda kendarai hingga proses alami seperti hujan yang turun dari langit.
Secara sederhana, termodinamika adalah “aturan main” tentang bagaimana energi berpindah dan berubah bentuk. Bayangkan Anda sedang memasak air: panas dari kompor mengalir ke air, membuat molekulnya bergerak lebih cepat hingga mendidih. Itu adalah termodinamika dalam aksi! Ilmu ini tidak hanya membantu kita memahami fenomena sehari-hari, tetapi juga menjadi fondasi teknologi modern seperti pembangkit listrik, pesawat terbang, dan bahkan panel surya.
Mengapa termodinamika penting? Tanpanya, kita tidak akan bisa merancang mesin yang efisien atau memprediksi perubahan iklim. Artikel ini akan membawa Anda menyelami dunia termodinamika: dari definisi dasar, hukum-hukum yang mengaturnya, hingga penerapannya yang mungkin tidak pernah Anda sadari sebelumnya. Baik Anda pelajar yang sedang mempersiapkan ujian, mahasiswa teknik, atau sekadar penasaran, panduan ini dirancang untuk menjawab semua pertanyaan Anda. Mari kita mulai dengan memahami apa itu termodinamika dan bagaimana ilmu ini berkembang hingga menjadi bagian tak terpisahkan dari kehidupan kita.
Apa Itu Termodinamika?
Termodinamika berasal dari dua kata Yunani: therme (panas) dan dynamis (kekuatan atau gerakan). Dalam fisika, termodinamika didefinisikan sebagai studi tentang hubungan antara panas, kerja, dan energi dalam suatu sistem. Sederhananya, ilmu ini menjelaskan bagaimana energi berpindah dari satu tempat ke tempat lain dan bagaimana ia berubah bentuk—misalnya, dari panas menjadi gerakan mekanis seperti saat piston mesin mobil berputar.
Untuk pemula, bayangkan termodinamika seperti seorang wasit dalam pertandingan energi. Ia menetapkan aturan: energi tidak bisa diciptakan atau dimusnahkan, hanya diubah bentuknya; dan setiap perubahan selalu meninggalkan jejak, seperti meningkatnya kekacauan (entropi). Ilmu ini berlaku untuk segala hal, mulai dari secangkir teh yang mendingin hingga reaksi di dalam bintang.
Sejarah Singkat Termodinamika
Termodinamika mulai berkembang pada abad ke-17 dan 18, saat para ilmuwan berusaha memahami mesin uap—teknologi revolusioner pada masa Revolusi Industri. Salah satu tokoh kunci adalah Sadi Carnot (1824), yang memperkenalkan konsep siklus mesin ideal (siklus Carnot), meletakkan dasar hukum kedua termodinamika. Kemudian, Rudolf Clausius mengembangkan ide entropi pada 1850, sementara James Prescott Joule membuktikan bahwa panas adalah bentuk energi. Kontribusi mereka, bersama ilmuwan lain seperti Lord Kelvin, membentuk termodinamika modern yang kita kenal hari ini.
Dari mesin uap hingga fisika kuantum, termodinamika telah berevolusi menjadi alat penting dalam sains dan teknologi. Sekarang, mari kita jelajahi hukum-hukum dasar yang menjadi tulang punggung ilmu ini.
Hukum Termodinamika
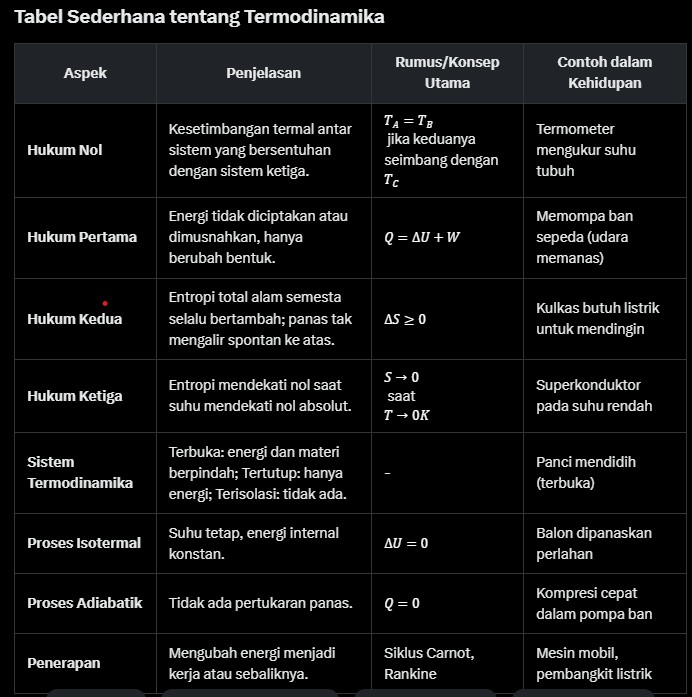
Termodinamika diatur oleh empat hukum utama yang masing-masing menjelaskan aspek berbeda dari perilaku energi. Mari kita bahas satu per satu dengan contoh dan visual yang mudah dipahami.
Hukum Nol Termodinamika
Hukum ini menyatakan bahwa jika dua sistem berada dalam kesetimbangan termal dengan sistem ketiga, maka keduanya juga berada dalam kesetimbangan termal satu sama lain. Sederhananya, ini adalah dasar pengukuran suhu. Misalnya, saat Anda menggunakan termometer, hukum nol memastikan bahwa suhu tubuh Anda dan termometer menjadi sama setelah beberapa detik. Hukum ini ditemukan belakangan, tetapi diberi nomor “nol” karena sifatnya yang mendasar.
Hukum Pertama Termodinamika
Dikenal sebagai hukum konservasi energi, hukum ini menyatakan: “Perubahan energi internal suatu sistem sama dengan panas yang masuk dikurangi kerja yang dilakukan sistem.” Dalam rumus:
Q = \Delta U + W
- ( Q ): Panas yang ditambahkan ke sistem
\Delta U: Perubahan energi internal- ( W ): Kerja yang dilakukan sistem
Contoh: Saat Anda memompa ban sepeda, udara di dalamnya memanas karena kerja yang Anda lakukan. Diagram tekanan-volume (PV) sering digunakan untuk memvisualisasikan proses ini—bayangkan grafik garis yang menunjukkan bagaimana volume menyusut saat tekanan meningkat.
Hukum Kedua Termodinamika
Hukum ini memperkenalkan konsep entropi, ukuran kekacauan dalam sistem. Ia menyatakan bahwa dalam proses alami, entropi total alam semesta selalu bertambah. Dengan kata lain, panas tidak bisa mengalir spontan dari benda dingin ke benda panas tanpa kerja tambahan—itulah mengapa kulkas butuh listrik!
Contoh nyata: Mesin panas seperti mobil Anda mengubah panas menjadi kerja, tetapi tidak 100% efisien. Siklus Carnot, proses ideal untuk mesin panas, menunjukkan batas efisiensi ini. Diagramnya (grafik PV) memperlihatkan empat tahap: ekspansi isotermal, ekspansi adiabatik, kompresi isotermal, dan kompresi adiabatik.
Hukum Ketiga Termodinamika
Hukum ini menyatakan bahwa entropi suatu sistem mendekati nol saat suhu mendekati nol absolut (-273,15°C). Ini penting dalam fisika modern, misalnya untuk memahami superkonduktor atau helium cair. Namun, mencapai nol absolut secara praktis tidak mungkin karena membutuhkan energi tak terbatas.
Hukum-hukum ini adalah fondasi termodinamika, dan untuk memahaminya lebih lanjut, kita perlu menyelami konsep dan proses yang mendasarinya.
Konsep dan Proses Termodinamika
Termodinamika tidak hanya tentang hukum, tetapi juga tentang bagaimana energi berperilaku dalam sistem tertentu. Mari kita bahas konsep dasar dan prosesnya.
Sistem Termodinamika
Sistem adalah bagian dari alam semesta yang kita amati, dikelilingi oleh batas. Ada tiga jenis:
- Terbuka: Energi dan materi bisa masuk/keluar (misalnya, panci mendidih).
- Tertutup: Hanya energi yang bisa masuk/keluar (misalnya, botol termos).
- Terisolasi: Tidak ada pertukaran energi atau materi (misalnya, alam semesta itu sendiri).
Proses Termodinamika
Proses adalah cara sistem berubah dari satu keadaan ke keadaan lain. Berikut adalah empat proses utama:
- Isotermal: Suhu tetap, energi internal konstan (
\Delta U = 0). Contoh: Udara dalam balon yang dipanaskan perlahan. - Adiabatik: Tidak ada pertukaran panas (
Q = 0). Contoh: Kompresi cepat dalam pompa ban. - Isobarik: Tekanan tetap. Contoh: Air mendidih dalam tekanan atmosfer.
- Isokhorik: Volume tetap. Contoh: Gas dipanaskan dalam tabung tertutup.
Setiap proses bisa divisualisasikan dalam diagram PV, di mana sumbu x adalah volume dan sumbu y adalah tekanan. Misalnya, proses isotermal digambarkan sebagai kurva hiperbolik, sementara adiabatik lebih curam.
Variabel Termodinamika
- Tekanan (P): Gaya per satuan luas.
- Volume (V): Ruang yang ditempati sistem.
- Suhu (T): Ukuran energi kinetik molekul.
- Entropi (S): Tingkat kekacauan.
Konsep ini menjadi dasar untuk memahami cabang-cabang termodinamika yang lebih spesifik.
Cabang Termodinamika
Termodinamika memiliki beberapa cabang yang menyesuaikan pendekatannya dengan kebutuhan tertentu:
- Termodinamika Klasik: Berfokus pada sistem makroskopis (tekanan, suhu, volume) tanpa melihat molekul. Cocok untuk teknik mesin.
- Termodinamika Statistik: Menganalisis perilaku molekul untuk menjelaskan sifat makroskopis. Penting dalam fisika modern.
- Termodinamika Kimia: Mempelajari reaksi kimia dan perubahan energi, seperti pembakaran bahan bakar.
- Termodinamika Teknik: Aplikasi praktis untuk desain mesin, turbin, dan sistem energi.
Perbedaan utama ada pada skala dan pendekatan: klasik bersifat praktis, sementara statistik lebih teoritis. Cabang-cabang ini menunjukkan fleksibilitas termodinamika dalam berbagai disiplin ilmu.
Penerapan Termodinamika dalam Kehidupan
Termodinamika bukan hanya teori—it’s everywhere! Berikut adalah beberapa contoh penerapannya:
Teknologi
- Mesin Uap: Hukum pertama dan kedua digunakan untuk mengubah panas menjadi kerja di lokomotif tua.
- Kulkas: Proses adiabatik dan isotermal memungkinkan pendinginan dengan siklus kompresi uap.
- Turbin: Pembangkit listrik mengandalkan siklus Rankine atau Brayton untuk menghasilkan energi.
Alam
- Siklus Air: Penguapan (panas masuk) dan kondensasi (panas keluar) adalah proses termodinamika alami.
- Metabolisme Tubuh: Tubuh Anda mengubah energi kimia dari makanan menjadi panas dan kerja—sesuai hukum pertama.
Industri
- Pembangkit Listrik: PLTU (Pembangkit Listrik Tenaga Uap) menggunakan siklus termodinamika untuk menghasilkan listrik dari batu bara atau gas.
- Manufaktur: Proses peleburan logam atau pendinginan material melibatkan perpindahan panas yang diatur termodinamika.
Penerapan ini menunjukkan bahwa termodinamika adalah jembatan antara sains dan kehidupan nyata.
Contoh Soal dan Pembahasan
Mari kita uji pemahaman Anda dengan dua contoh soal:
Soal Dasar
Sebuah gas dalam wadah melakukan kerja 500 J saat menerima panas 700 J. Berapa perubahan energi internalnya?
Jawab:
Gunakan hukum pertama:
Q = \Delta U + W
700 = \Delta U + 500
\Delta U = 700 - 500 = 200 J
Energi internal bertambah 200 J.
Soal Lanjutan
Sebuah mesin Carnot bekerja antara suhu 600 K dan 300 K. Berapa efisiensinya?
Jawab:
Efisiensi Carnot:
\eta = 1 - \frac{T_c}{T_h}
\eta = 1 - \frac{300}{600} = 1 - 0.5 = 0.5 atau 50%.
Ini adalah efisiensi maksimum teoritis.
Soal-soal ini membantu memahami konsep secara praktis.
Fakta Menarik dan Mitos Termodinamika
- Fakta: Hukum kedua membuktikan mesin perpetual motion (gerak abadi) mustahil—energi selalu hilang sebagai panas.
- Trivia: Termodinamika menjelaskan mengapa kopi Anda dingin jika dibiarkan—entropi mengambil alih!
- Mitos: Banyak yang percaya kulkas “menciptakan dingin.” Padahal, ia hanya memindahkan panas keluar.
Fakta ini membuat termodinamika lebih relatable dan menarik.
Kesimpulan
Termodinamika adalah ilmu yang mengatur energi dalam kehidupan kita, dari hukum-hukum dasarnya hingga aplikasi canggih seperti turbin dan kulkas. Hukum nol hingga ketiga memberikan kerangka untuk memahami panas, kerja, dan entropi, sementara proses seperti isotermal dan adiabatik menjelaskan bagaimana energi berpindah. Cabang-cabangnya menunjukkan luasnya aplikasi, dari fisika teoritis hingga teknik praktis. Dengan contoh soal dan fakta menarik, kita melihat betapa relevannya ilmu ini. Jadi, lain kali Anda menyalakan AC atau memasak, ingat: termodinamika sedang bekerja untuk Anda. Ingin tahu lebih banyak? Terus eksplorasi dunia energi yang menakjubkan ini!
Panas adalah salah satu bentuk energi yang berpindah akibat perbedaan suhu, sedangkan energi adalah kemampuan melakukan kerja dalam berbagai bentuk (kinetik, potensial, dll.).
Hukum kedua menyatakan bahwa alam semesta cenderung menuju kekacauan maksimum—seperti air yang menyebar saat tumpah, tidak bisa kembali sendiri.
Siklus Carnot adalah proses ideal untuk mesin panas, menunjukkan efisiensi maksimum antara dua suhu.
Kulkas memindahkan panas dari dalam ke luar melalui kompresi dan ekspansi gas, sesuai hukum pertama dan kedua.